Hidruros
metálicos
Los hidruros metálicos son compuestos binarios constituidos por hidroógeno y un elemento metálico. Se caracterizan por ser
los únicos compuestos en los que el hidrógeno funciona como numero de oxidación
-1.
Formulación de los hidruros metálicos:
Se formulan escribiendo primero el símbolo
del elemento metálico y después el del hidrógeno: MHm, en el cual
M es el metal, H es el hidrógeno y m es el número de oxidación del metal. Se nombran con la palabra hidruro, la preposición de y después el
nombre del metal. En el sistema de Ginebra se utilizan
–ico y –oso para determinar el mayor y menor numero de oxidación del elemento
metalico, mientras que en el sistema IUPAC se señala con números.
1.- NaH (hidruro de sodio)
El hidruro de sodio es un
compuesto químico que tiene por fórmula NaH. Es usado como una base fuerte en las síntesis orgánicas. El NaH es
representativo de los hidruros salinos compuesto de iones Na+ (catión) e H− (anión). Es un material ionizable, insoluble en solventes
orgánicos, pero soluble en sodio fundido.
Usos:
· Obtención de la sodamida.
· Como una base fuerte.
· En la reducción de óxidos en metales, en combinación con hidróxido de sodio
fundido.
· Se utiliza mucho a altas temperaturas como agente reductor.
· En reacciones donde se necesita un catalizador que actúe como reductor.
· En la desprotonización de sales de sulfonio y en el sulfóxido de
dimetilo.
·
En la preparación
indirecta de cetonas y epóxidos.
2.-CaH2 (hidruro de calcio)
El hidruro de calcio (CaH2) es un compuesto químico formado por un átomo de
calcio y dos átomos de hidrógeno. Es un sólido de color blanco que absorbe la
humedad, forma parte de los hidruros iónicos o salinos.
Usos:
- · Agente desecante.
- · Fuente de hidrógeno molecular.
- · Inflado de globos meteorológicos.
3.- LiH (hidruro de litio)
El hidruro de litio (LiH) es
un compuesto químico de litio e hidrógeno. Es un sólido cristalino
incoloro, aunque las muestras comerciales presentan aspecto grisáceo. Esta sal
inorgánica está formada por cationes litio Li+ y aniones hidruro H-, y tiene un alto
punto de fusión, de 689 °C.
Usos:
- Como desecante.
- Como precursor para la síntesis de hidruro de litio y aluminio (LiAlH4).
- En generadores de hidrógeno.
- En el almacenamiento de hidrógeno.
- Tanto refrigerante como blindaje en reactores nucleares.
- En la fabricación de cerámica.
- Como agente reductor. (redox)
Hidruros no-metálicos
Los hidruros no-metálicos se forman con los no-metales y
algunos metaloides de los grupos III-A, IV-A, V-A, VI-A y VII-A en combinación
con el Hidrógeno. En los hidruros no-metálicos el Hidrógeno trabaja con el
numero de oxidación +1.
Hidruros no-metálicos Grupos III-A al V-A:
Están unidos por enlaces covalentes y se diferencian de los
hidrácidos en que sus disoluciones acuosas no tienen propiedades ácidas. Los
elementos que los forman son: Grupo III: Boro, Grupo IV: Carbono y silicio y
Grupo V: Nitrógeno, arsénico, fósforo y antimonio.
Nomenclatura: Se nombran con la palabra hidruro seguida del
nombre del semimetal correspondiente. Se utilizan prefijos numerales para
indicar el numero de átomos de hidrogeno y del semimetal del compuesto. Todos
tienen nombres especiales admitidos por la IUPAC.
Formulación de los hidruros no-metálicos Grupos III a V-A:
El símbolo del semimetal se coloca a la izquierda y el del
hidrogeno a la izquierda: XH
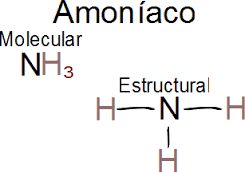
1.- NH3 (amoniaco)
Es un compuesto químico que consiste en un átomo de nitrógeno (N) y tres átomos de hidrógeno (H). Su fórmula es NH3. A temperatura ambiente, es un gas
incoloro de olor muy penetrante y nauseabundo. Producido naturalmente por
descomposición de la materia orgánica y también es fabricado industrialmente.
Es fácilmente soluble y se evapora rápidamente. Generalmente se vende
en forma líquida y no se debe de juntar con lejía,
ya que produce una reacción tóxica.
Usos:
- El amoníaco concentrado al 15 % se usa para limpieza doméstica como desengrasante.
- Concentrado al 25 % o más el amoníaco es usado para fines industriales.
2.- CH4 (metano)
Es una sustancia no polar que se presenta en forma de gas
a temperaturas y presiones ordinarias. Es incoloro, inodoro e insoluble en agua.
En la naturaleza se produce como producto final de la putrefacción anaeróbica de las plantas. Es muy
peligroso ya que es fácilmente inflamable y explosivo. En las últimas décadas
ha cobrado importancia la explotación comercial como fuente de energía. El
metano es un gas de efecto invernadero relativamente
potente que contribuye al calentamiento global.
Usos:
- Combustible (gas natural)
- Se inyecta en pozos petroleros para extracción de petróleo
- En procesos industriales químicos se usa en los procesos para producir hidrogeno, acido acético, entre otros compuestos.
- Al calentar metano a temperaturas elevadas se obtiene acetileno, al acetileno se le añade agua catalíticamente y se obtiene acetaldehído , a partir del cual se obtiene acido acético.
3.- PH3 (fosfina)
Es un gas incoloro, inflamable, que explota a temperatura ambiente y
que huele a ajo o a pescado podrido. Pequeñas cantidades ocurren naturalmente
provenientes de la degradación de materia orgánica. Es levemente soluble en agua.
Usos:
- En industrias de semiconductores y de plásticos.
- En la producción de un retardador de llamas.
- Como insecticida en granos almacenados.
- La fosfina presente en la atmósfera procede principalmente de las emisiones y emanaciones de procesos industriales, por el uso de fosfuros como raticidas y fumigantes, y por la acción del agua sobre fosfuros presentes como impurezas en materiales industriales.
Hidruros no-metálicos Grupos VI-A y VII-A:
Los hidruros no-metálicos de los grupos VI y VII-A de la tabla periódica
también son conocidos como haluros de hidrógeno por que el hidrogeno se combina
con los elementos del grupo VIII que son los halógenos. En solución acuosa
forman soluciones acidas que llevan por nombre hidrácidos.
Formulación de los hidruros no-metálicos de los grupos VI y VII-A:
En estos compuestos e hidrogeno se escribe a la izquierda y el no-metal a
la derecha: HX.
Nomenclatura stock: Se nombran añadiendo el sufijo –uro al no metal, la preposición de y al
final la palabra hidrógeno. Nota: En
estos compuestos la nomenclatura stock hace referencia a la fase gaseosa del
compuesto, la cual es lo antes escrito. No hace referencia a los números romanos.
Nomenclatura tradicional o
clásica: Se utiliza en la fase acuosa del
compuesto. Se escribe la palabra acido, el nombre del no metal y la terminación
–hídrico.
1.- H2S (sulfuro de hidrógeno)
Es un hidrácido de fórmula H2S. Este gas,
más pesado que el aire, es inflamable, incoloro, tóxico, odorífero:
su olor es el de materia orgánica en descomposición, como de huevos podridos. En el organismo humano desempeña
funciones esenciales. También es llamado acido sulfhídrico.
Usos:
- Se emplea en la purificación de ácidos sulfúrico y clorhídrico.
- Es un precipitante de los sulfuros de metales.
- Se emplea como reactivo analítico.
- Sirve como fuente de azufre.
2.- HF (ácido fluorhídrico)
Es la solución acuosa del fluoruro
de hidrógeno, es un compuesto químico altamente peligroso formado por hidrógeno y flúor (HF)X. No debe estar en contacto con el
vidrio por que puede corroerlo, por esto se manipula bajo fríos extremos
utilizando material de plástico.
Usos:
- Se utiliza en química orgánica en la obtención de compuestos orgánicos fluorados.
- Como catalizador en petroquímica.
- Para obtener criolita artificial que se emplea en la obtención del aluminio.
- Fluoruros inorgánicos como el hexafluoruro de uranio y a veces como disolvente.
- En la industria y preparación de vidrio o cristal, en el tallado y grabado del mismo.
3.- HCl (ácido clorhídrico)
Es una disolución acuosa del gas cloruro de hidrógeno
(HCl). Es muy corrosivo y ácido. Se emplea comúnmente como reactivo químico y se trata
de un ácido fuerte que se disocia completamente
en disolución acuosa. Es suficiente para matar a un ser humano, en un litro de
agua. A temperatura ambiente, es un gas
ligeramente amarillo, corrosivo, no inflamable, más pesado que el aire, de olor
fuertemente irritante. Cuando se expone al aire, el cloruro de hidrógeno forma
vapores corrosivos densos de color blanco.
Usos:
- El decapado del acero.
- La acidificación de pozos de petróleo.
- La fabricación de alimentos.
- La producción de cloruro de calcio.
- El tratamiento de minerales.
Anhídridos
Los anhídridos o también llamados óxidos no metálicos u óxidos ácidos, son
compuestos que resultan de la unión química entre el oxigeno y un no metal. Se
les llama óxidos ácidos por que al combinarlos con agua producen ácidos.
Formulación de los anhídridos:
Su formula general es X2Ox, donde X
es el no metal, 2 es el numero de oxidación del oxigeno, O es el oxigeno y x es
el numero de oxidación (cuadro de anhídridos). Se utiliza el cuadro que esta en
la tabla periódica. Existe otra manera de nombrarlos, la cual consiste en
utilizar los prefijos griegos: di (2), tri (3), tetra (4), penta (5), hexa (6),
hepta (7), etc.
1.- CO (oxido de carbono II)
Es un gas inodoro, incoloro y altamente tóxico. Puede causar la muerte cuando se respira en niveles elevados. Se produce por
la combustión deficiente de sustancias como gas, gasolina, keroseno, carbón, petróleo, tabaco o madera.
Usos:
- Subproducto de la combustión incompleta de combustible para vehículos o de aceite o gas en mecheros.
- En metalurgia y en plásticos, y como intermediario químico.
2.- CO2 (dióxido de carbono u oxido de carbono IV)
Es un gas compuesto por dos átomos de oxígeno y uno de carbono. Como parte del ciclo del carbono, las plantas usan la energía lumínica del Sol para fotosintetizar
carbohidratos a partir del dióxido de carbono y el agua, expulsando oxígeno
como desecho de la reacción. Las
plantas no pueden hacer la fotosíntesis por la noche o en oscuridad,
desprendiendo una cantidad menor de dióxido de carbono debido a la respiración celular. La mayoría de los organismos en la Tierra que respiran expulsan dióxido de
carbono como desecho del metabolismo, incluyendo al ser humano. También es producido
por la combustión del carbón y los hidrocarburos,
y es emitido por volcanes, géiseres y fuentes volcánicas.
Usos:
- Agente extintor enfriando el fuego (en forma de nieve carbónica) y dificultando el contacto de las llamas con el oxígeno del aire.
- En la industria alimentaria, se utiliza en bebidas carbonatadas para darles efervescencia.
- Como ácido inocuo o poco contaminante. Puede ayudar a cuajar lácteos de una forma más rápida y por tanto barata, sin añadir ningún sabor.
- Para neutralizar residuos alcalinos sin añadir otro ácido más contaminante como el sulfúrico.
- Como abono.
- Como una clase de líquido refrigerante en máquinas frigoríficas o congelado como hielo seco.
- Para crear niebla artificial y apariencia de hervor en agua en efectos especiales en el cine y los espectáculos.
- Como agente extractor cuando se encuentra en condiciones supercríticas. Actualmente se reduce a la obtención de alcaloides como la cafeína y determinados pigmentos.
- Es utilizado también como material activo para generar luz coherente.
3.- SO2 (dióxido de azufre)
Es un gas incoloro con un olor asfixiante. Es una sustancia reductora que
con el tiempo, el contacto con el aire y la humedad, se convierte en trióxido de azufre. La velocidad de esta
reacción en condiciones normales es baja. En agua se disuelve formando una
disolución ácida.
Usos:
- Tiene propiedades desinfectantes, fue utilizado durante siglos en la desinfección.
- También se utiliza en la industria alimenticia como conservante y antioxidante, generalmente de zumos, frutos secos, mermeladas, vino etc.
- Es un intermedio en la fabricación del ácido sulfúrico.
- Por reacción con cloro produce cloruro de sulfuril (SO2Cl2), que es un importante intermedio en la industria química.
- En estado líquido es un buen disolvente.















No hay comentarios:
Publicar un comentario